Salud
Hallan nuevas combinaciones de fármacos eficaces en ratones contra el tumor cerebral más complejo
El texto se ha copiado correctamente en el portapapeles
Investigadores del grupo de Telómeros y Telomerasa del Centro Nacional de Investigaciones Oncológicas (CNIO) han hallado nuevas combinaciones de fármacos eficaces en ratones contra el glioblastoma, el tumor cerebral “de peor pronóstico” y más complejo.
El estudio identifica nuevas combinaciones de fármacos que, en ratones, evitan la aparición de resistencias en el tratamiento contra glioblastoma y desvela también una conexión “insospechada” entre el gen Ras, implicado en numerosos cánceres, y el mantenimiento de los telómeros en las células, lo que abre “nuevas vías de investigación”. La investigación ha sido publicada en la revista ‘EMBO Molecular Medicine’.
“Tenemos un resultado doble”, explica la jefa del grupo de Telómeros y Telomerasa del Centro Nacional de Investigaciones Oncológicas (CNIO), María A. Blasco. “Buscábamos fármacos ya aprobados capaces de bloquear una nueva diana, y los hemos encontrado, pero además en el proceso hemos descubierto que algunas rutas moleculares importantes para el cáncer también regulan la protección de los telómeros. Es un aspecto muy interesante de la biología del cáncer que hasta ahora no se conocía”.
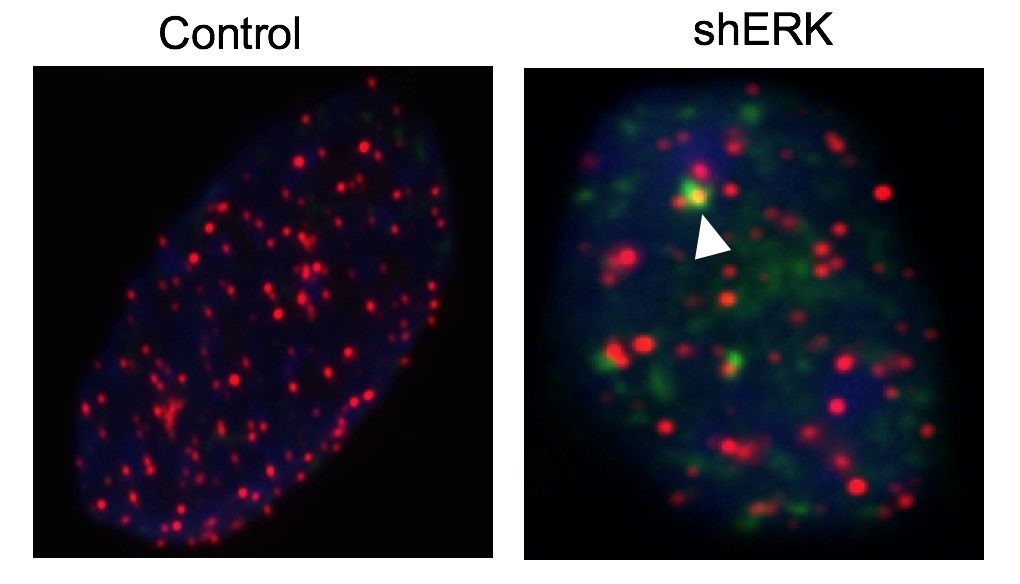
Los telómeros constituyen los extremos de los cromosomas, que es donde está la información genética de la célula. El grupo del CNIO ha descubierto en los últimos años que atacar los telómeros de las células tumorales puede ser una estrategia eficaz contra el cáncer. En concreto, hace dos años demostraron que bloqueando una proteína esencial en los telómeros, llamada TRF1, se lograba frenar el crecimiento del glioblastoma humano y murino en modelos de ratón.
El glioblastoma es el “cáncer cerebral más común”, con una esperanza de vida media de unos 14 meses, indica la entidad en un comunicado. Una de las razones de que sea tan difícil de tratar es que posee una población de células madre capaces de regenerar el tumor. Hace dos años los investigadores del CNIO observaron que las células de glioblastoma tienen mucha proteína TRF1, de la que sabían que se expresa especialmente en las células madre. Decidieron intentar bloquearla, con compuestos desarrollados específicamente en el CNIO, y la estrategia dio resultado: la supervivencia de los animales mejoraba de forma importante -hasta un 80%-.
En previsión de la aparición de resistencias a los inhibidores desarrollados, el grupo decidió buscar más compuestos activos contra TRF1, y hacerlo entre fármacos ya aprobados para el tratamiento del cáncer o en uso en ensayos clínicos con pacientes. El resultado de esa búsqueda es el trabajo que ahora se publica.
Los investigadores buscaron inhibidores de TRF1 en la colección de 114 fármacos antitumorales del CNIO, compuestos que actúan sobre rutas moleculares ya conocidas. El screening reveló que varios de estos fármacos son capaces de bloquear TRF1 en células de glioblastoma y de cáncer de pulmón.
Además, descubrieron que el mecanismo de acción de esos fármacos toca “rutas moleculares muy implicadas en el cáncer”, como la de Ras, y del todo independientes de las que siguen los primeros inhibidores desarrollados en el CNIO.
“Conocer estas rutas nos permite identificar nuevas maneras de atacar los telómeros y combatir así el cáncer. Es una estrategia innovadora en la que nuestro grupo ha sido del todo pionero”, explica la coautora del estudio Jessica Louzame.
Una vez identificados los fármacos capaces de bloquear TRF1, los investigadores fueron un paso más allá, probando su actividad combinada con los primeros compuestos inhibidores de TRF1 desarrollados por el CNIO.
Estudiaron su eficacia en animales modelo con glioblastoma procedente de pacientes, y de nuevo los resultados “han sido positivos”. Con el uso combinado de los fármacos se obtiene un efecto sinérgico y se evita la aparición de resistencias.
“Este trabajo muestra que las combinaciones de los inhibidores de TRF1 podrían ser una estrategia para bloquear eficazmente el crecimiento del cáncer y el desarrollo de resistencias”, afirma el también autor del estudio Giuseppe Bosso.
El trabajo ha sido financiado por el Ministerio de Ciencia, Innovación y Universidades, el Instituto de Salud Carlos III, la Fundación Botín y Banco Santander a través de Santander Universidades, Worlwide Cancer Research y el Programa Internacional Becas de Doctorado 'la Caixa'-Severo Ochoa, financiada por la Fundación 'la Caixa'.
(SERVIMEDIA)
13 Jun 2019
ARS/caa



