Ciencia
Resucitan los ancestros de la herramienta de edición genética Crispr de hace 2.600 millones de años
- Investigadores españoles ayudan a descifrar el origen de esta tecnología y constatan su actividad original
El texto se ha copiado correctamente en el portapapeles
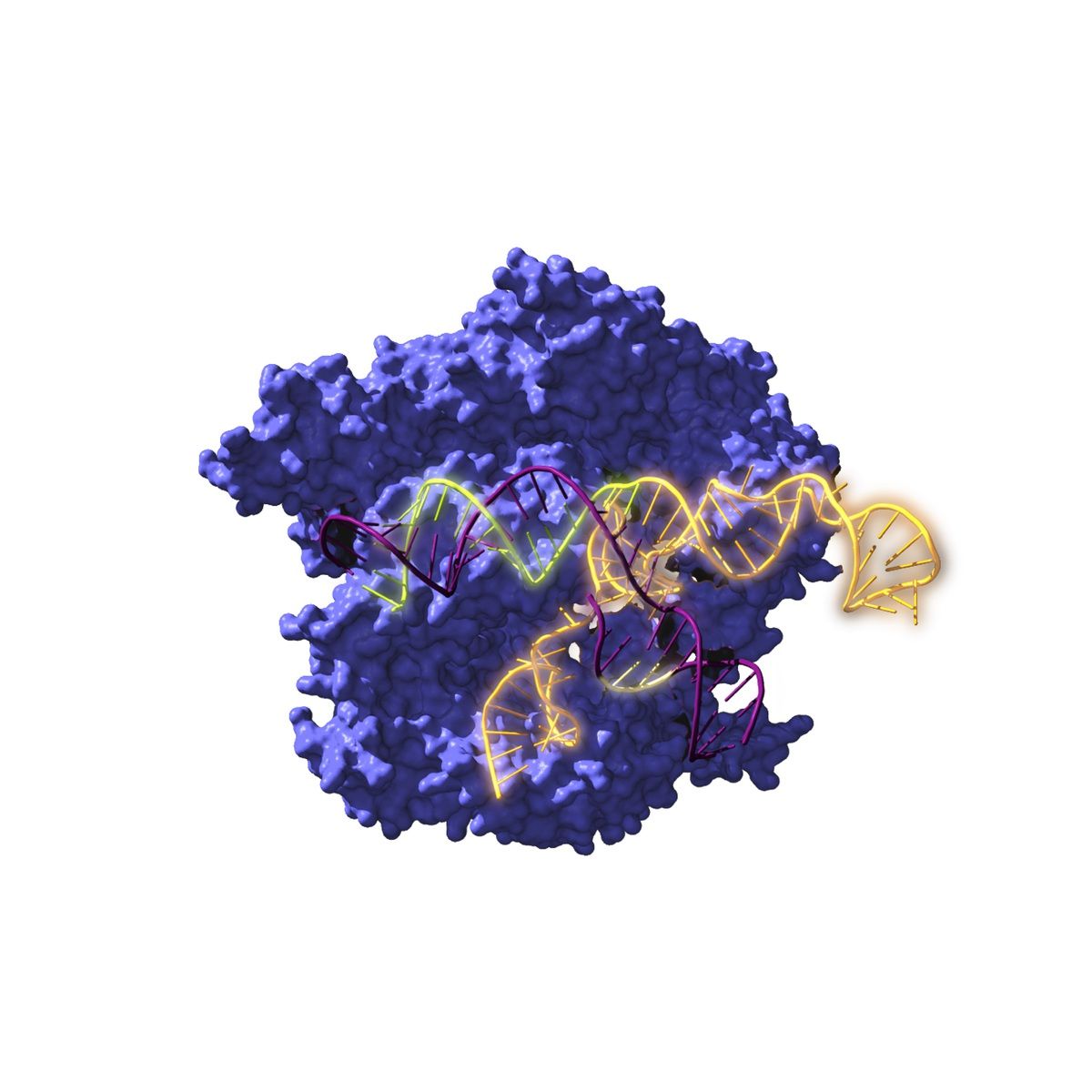
Un estudio de un grupo de investigación internacional, liderado por científicos españoles, reconstruye por primera vez ancestros del conocido sistema Crispr-Cas de hace 2.600 millones de años y estudia su evolución a lo largo del tiempo.
El trabajo, publicado en la prestigiosa revista científica 'Nature Microbiology', abre nuevas vías en la manipulación de ADN y en el tratamiento de enfermedades como el cáncer o la diabetes, según sus autores. Los resultados apuntan a que los sistemas "revitalizados" no sólo funcionan, sino que "son más versátiles que las versiones actuales y podrían tener aplicaciones revolucionarias".
En el proyecto, dirigido por Rául Pérez Jiménez, investigador Ikerbasque de CIC nanoGUNE, participan equipos del Consejo Superior de Investigaciones Científicas, la Universidad de Alicante, el Centro de Investigación Biomédica en Red de Enfermedades Raras (Ciberer) y otras instituciones estatales e internacionales.
La investigación acaba de ser publicada en la revista ‘Nature Microbiology’, y "reconstruye por primera vez la historia evolutiva de los sistemas Cispr-Cas, desde ancestros de hace 2.600 millones de años hasta la actualidad".
El equipo de investigación realizó la reconstrucción informática de las secuencias Crispr ancestrales, las ha sintetizado y ha estudiado y confirmado su funcionalidad.
“Resulta sorprendente que podamos revitalizar proteínas Cas que debieron existir hace miles de millones de años y constatar que ya tenían entonces la capacidad de operar como herramientas de edición genética, algo que hemos confirmado en la actualidad editando con éxito genes en células humanas” destacó Lluís Montoliu, investigador del Centro Nacional de Biotecnología del CSIC (CNB-CSIC) y del Ciberer, y responsable del equipo que ha validado funcionalmente estas Cas ancestrales en células humanas en cultivo.
Una forma radicalmente diferente de encontrar nuevos sistemas es buscarlos en el pasado, que es precisamente la base de esta investigación. El grupo de Nanobiotecnología de nanoGUNE, liderado por Raúl Pérez-Jiménez, lleva años estudiando la evolución de las proteínas desde el origen de la vida hasta nuestros días.
Para ello, realizan reconstrucciones ancestrales de proteínas y genes de organismos extintos para observar qué cualidades tienen y si son utilizables en aplicaciones biotecnológicas. Se trata de un viaje en el tiempo llevado a cabo por medio de técnicas bioinformáticas.
La tecnología Crispr-Cas permite hoy en día cortar y pegar trozos de material genético en cualquier célula, lo cual hace posible su utilización para editar el ADN. Los esfuerzos de investigación actuales se centran en encontrar nuevas versiones de sistemas CRISPR-Cas con propiedades distintas en los lugares más recónditos del planeta.
EL CRISPR DEL FUTURO
Otra interesante conclusión del estudio es que el sistema Crispr-Cas ha ido haciéndose más complejo a lo largo del tiempo, lo cual es una señal del carácter adaptativo del mismo, ya que ha ido amoldándose a las nuevas amenazas de virus que las bacterias han sufrido a lo largo de la evolución.
“Esta investigación supone un extraordinario avance en el conocimiento sobre el origen y evolución de los sistemas Crispr-Cas. En cómo la presión selectiva de los virus ha ido puliendo a lo largo de miles de millones de años una maquinaria rudimentaria, poco selectiva en sus inicios, hasta convertirla en un sofisticado mecanismo de defensa capaz de distinguir con gran precisión el material genético de invasores indeseados que debe destruir, de su propio ADN que debe preservar”, explicó el investigador de la Universidad de Alicante y descubridor de la técnica Crispr-Cas, Francis Mojica.
Añadió que, en la vertiente aplicada, “el trabajo representa una forma original de abordar el desarrollo de herramientas CRISPR para generar nuevos instrumentos y mejorar las derivadas de los existentes en organismos actuales”.
Para Ylenia Jabalera, investigadora del proyecto en nanoGUNE, “este logro científico hace posible disponer de herramientas de edición genética con propiedades distintas a las actuales, mucho más flexibles, lo cual abre nuevas vías en la manipulación de ADN y tratamiento de enfermedades tales como ELA, cáncer, diabetes, o incluso como herramienta de diagnóstico de enfermedades”.
Dicho trabajo es el resultado de una investigación internacional de varios centros y laboratorios liderado por nanoGUNE en colaboración con los grupos de Francis Mojica, de la Universidad de Alicante, quien acuñó el acrónimo Crispr; Lluís Montoliu, investigador del CNB-CSIC y del Ciberer y uno de los referentes sobre Crispr en España; Marc Güell de la Universidad Pompeu Fabra y Premio Nacional en Investigación y Transferencia Tecnológica en el campo de la edición de genomas con fines terapéuticos; Miguel Ángel Moreno-Pelayo, jefe del servicio de Genética del Hospital Ramón y Cajal, y miembro del Ciberer; y Benjamin Kleinstiver, del Hospital General de Massachusetts y de la Escuela de Medicina de Harvard, referente mundial en el diseño de sistemas Crispr-Cas.
(SERVIMEDIA)
02 Ene 2023
CAG/clc



