ELA
La acumulación de ‘proteínas basura’, posible causa del envejecimiento y del origen de la ELA
El texto se ha copiado correctamente en el portapapeles
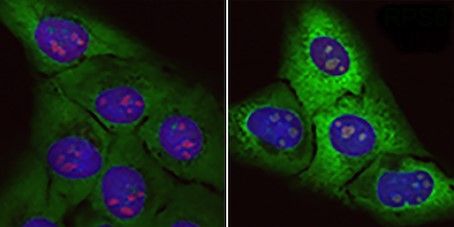
El Grupo de Inestabilidad Genómica del Centro Nacional de Investigaciones Oncológicas (CNIO) ha identificado la acumulación en las neuronas motoras de ‘proteínas basura’, que se acumulan de forma indebida e impiden el funcionamiento correcto de la célula, como posible causa del envejecimiento y el origen del tipo hereditario de la esclerosis lateral amiotrófica (ELA).
Según informó este viernes el centro de investigación, los resultados de este trabajo acaban de publicarse en la revista ‘Molecular Cell’. En concreto, estas ‘proteínas basura’ no funcionales que se acumulan son proteínas ribosomales, que normalmente constituyen los ribosomas, factorías moleculares encargadas de la producción de proteínas.
Así, este estudio aporta una nueva hipótesis para entender el origen de la ELA, al sugerir que tiene un origen similar a otro grupo de enfermedades raras conocidas como ribosomopatías, asociadas también a un exceso de proteínas ribosomales no funcionales. En el caso de la ELA, este problema está restringido a las neuronas motoras.
Por lo tanto, los científicos abren un nuevo frente en un área distinta como la investigación del envejecimiento. Los autores describieron un nuevo factor causal del proceso de envejecimiento: el estrés nucleolar, un concepto que engloba las alteraciones que sufren unos orgánulos llamados nucléolos, encargados de la producción de ribosomas.
En este sentido, la coautora del estudio, Vanesa Lafarga, explicó que “en nuestro trabajo reportamos un nuevo modelo que explica cómo el estrés nucleolar induce toxicidad en las células animales, y aportamos evidencias directas de que este tipo de estrés acelera el envejecimiento en mamíferos”.
UN ‘ALQUITRÁN’ QUE BLOQUEA EL ARN
La mayoría de pacientes de ELA hereditario comparten mutaciones en un gen llamado C9ORF72. Esta mutación deriva en la producción de unas proteínas o péptidos tóxicos. Estas toxinas se pegan al ADN y el ARN “como si fueran alquitrán”, lo que afecta a prácticamente todas las reacciones de la célula que usan estos ácidos nucleicos.
El estudio del CNIO muestra que la toxina tiene un efecto particularmente agudo en la fabricación de nuevos ribosomas, factorías de producción dentro de la célula, y que están constituidos por ARN y proteínas.
Así, al no poder completar su ensamblaje, “la célula va acumulando un exceso de proteínas ribosomales huérfanas, incapaces de formar ribosomas”, destacó el jefe del Grupo de Inestabilidad Genómica del CNIO, Óscar Fernández-Capetillo.
A esto añadió que “estas proteínas acaban colapsando los sistemas de limpieza celular, lo que finalmente deriva en la muerte de las neuronas motoras”.
VIA DE TRATAMIENTO
Para los autores, por primera vez este trabajo sugiere una similitud entre la causa de la ELA y otro tipo de enfermedades conocidas como ribosomopatías, también asociadas a la acumulación de proteínas ribosomales disfuncionales de manera generalizada en todas las células del cuerpo humano.
A partir de este hallazgo, el grupo del CNIO exploró una vía de solución. “Dado que el problema es el exceso de basura ribosomal, exploramos estrategias para que las células produzcan menos ribosomas”, destacó Fernández-Capetillo.
Para lograrlo apagaron con manipulación genética y farmacológica dos de los mecanismos de generación de ribosomas en tejidos in vitro, comprobando que, en efecto, al producir menos “basura”, la toxicidad se reduce.
No obstante, Fernández-Capetillo indicó que estos resultados que deben ser interpretados con prudencia: “Estamos en los primeros pasos para ver si podemos dar un ángulo terapéutico a estos descubrimientos”.
De momento, estos experimentos simplemente indican “la posible existencia de vías que no se habían explorado para buscar tratamientos” contra la ELA. “Debemos encontrar maneras de reducir la producción de ribosomas para que disminuya la basura, pero garantizando un número suficiente para el funcionamiento correcto de las células”, puntualizó el experto.
(SERVIMEDIA)
22 Mar 2024
ABG/MGR/clc/gja



