Vacunas
Miñones asegura que la vacuna de Hipra “es un hito científico y sanitario sin precedentes”
- Ante la recomendación de la EMA de su comercialización
El texto se ha copiado correctamente en el portapapeles
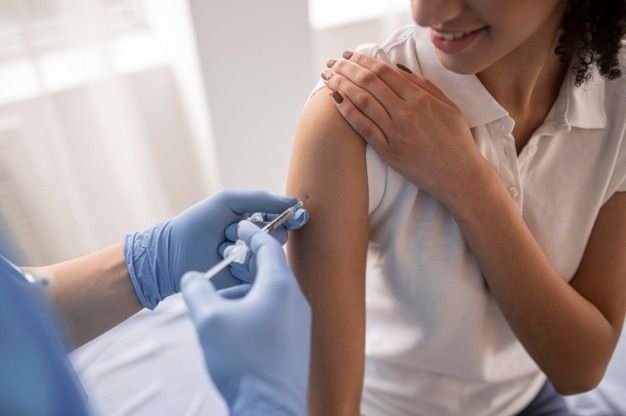
El ministro de Sanidad, José Manuel Miñones, valoró este jueves que la vacuna española de Hipra frente a la covid-19 “es un hito científico y sanitario sin precedentes que muestra el compromiso de España con la mejora de la salud de las personas, sin dejar a nadie atrás”, tras conocerse la noticia de que la Agencia Europea del Medicamento (EMA) recomendó hoy su comercialización.
Esta tarde, la EMA recomendó que se otorgue una autorización de comercialización condicional a la vacuna frente a la covid-19 ‘Bimervax’ de Hipra, indicada como dosis de refuerzo o ‘booster’ para aquellas personas a partir de 16 años que hayan recibido la pauta de primera vacuna con ARN mensajero, al menos 6 meses después de la última dosis de una vacuna recibida.
Por ello, Miñones agradeció a todos los profesionales del Ministerio de Sanidad y de la Agencia Española de Medicamentos y Productos Sanitarios (Aemps), su trabajo y asesoramiento regulatorio y científico para que la vacuna haya podido cumplir con las garantías de calidad, seguridad y eficacia que se exigen en la Unión Europea.
En la misma línea, el ministro de Sanidad aseguró que esta recomendación de autorización es un “hito clave” que da comienzo a una nueva etapa para la primera vacuna desarrollada en España, “cuya fabricación y suministro va a permitir seguir luchando frente a la pandemia en todo el mundo”.
MAYOR RESPUESTA INMUNE
La vacuna de Hipra frente a la covid-19 está basada en una proteína recombinante heterodimérica que contiene el sitio de unión al receptor (RBD, por sus siglas en inglés) de la proteína S (de 'spike', espiga en español) de las variantes alfa y beta del SARS-CoV-2. Esto significa que esta vacuna bivalente contiene información para inducir una respuesta en forma de anticuerpos contra dos variantes del SARS-CoV-2. Este antígeno está acompañado de un adyuvante que incrementa la respuesta inmune.
La evaluación científica de esta vacuna comenzó el pasado 20 de marzo y el Comité de Medicamentos de Uso Humano (CHMP, por sus siglas en inglés) de la EMA, formado por expertos de las autoridades competentes de los diferentes Estados miembros de la UE, entre ellos la Agencia Española de Medicamentos y Productos Sanitarios (Aemps), ha completado hoy esta evaluación, concluyendo por consenso que dispone de datos suficientemente sólidos sobre su calidad, seguridad y eficacia; es decir, que el balance beneficio-riesgo es positivo.
El principal estudio realizado con ‘Bimervax’ es un ensayo clínico que comparó la respuesta inmunitaria desencadenada por esta nueva vacuna con la desencadenada por la vacuna de ARNm autorizada ‘Comirnaty’, de BioNTech/Pfizer contra el SARS-CoV-2 en su variante original (Wuhan).
EFICACIA Y SEGURIDAD
Este ensayo recibió el visto bueno de la Aemps el pasado 1 de febrero de 2022. En él participaron 765 adultos que habían completado previamente la vacunación primaria con dos dosis de ‘Comirnaty’ y que posteriormente recibieron una dosis de refuerzo de ‘Bimervax’ o ‘Comirnaty’.
Por otra parte, el perfil de seguridad de ‘Bimervax’ es comparable al de otras vacunas contra la covid-19. Los efectos secundarios más comunes observados fueron dolor en el lugar de la inyección, dolor de cabeza, cansancio y dolor muscular. Por lo general, estos fueron de leves a moderados y desaparecieron unos pocos días después de la vacunación.
La seguridad y eficacia de la vacuna continuarán siendo monitorizadas a medida que la vacuna se use en toda la Unión Europea (UE), a través del sistema de farmacovigilancia europeo y estudios adicionales por parte de la empresa y las autoridades competentes.
En relación a esto, Hipra está obligada a proporcionar actualizaciones periódicas de seguridad. Además, los estudios independientes de las vacunas covid-19 coordinados por las autoridades de la UE brindarán más información sobre la seguridad y los beneficios a largo plazo de las vacunas en la población general.
Estas medidas permitirán a los reguladores evaluar rápidamente los datos que surgen de una variedad de fuentes diferentes y tomar las medidas reglamentarias necesarias para proteger la salud pública.
La Comisión Europea (CE) será ahora la responsable de otorgar la autorización de comercialización para que esta vacuna pueda distribuirse en todos los Estados miembro de la UE, como sucede con el resto de medicamentos autorizados por procedimiento centralizado.
(SERVIMEDIA)
30 Mar 2023
ABG/clc



