Salud
Pacientes con Piel de Mariposa denuncian que la burocracia sanitaria "abre heridas"
El texto se ha copiado correctamente en el portapapeles
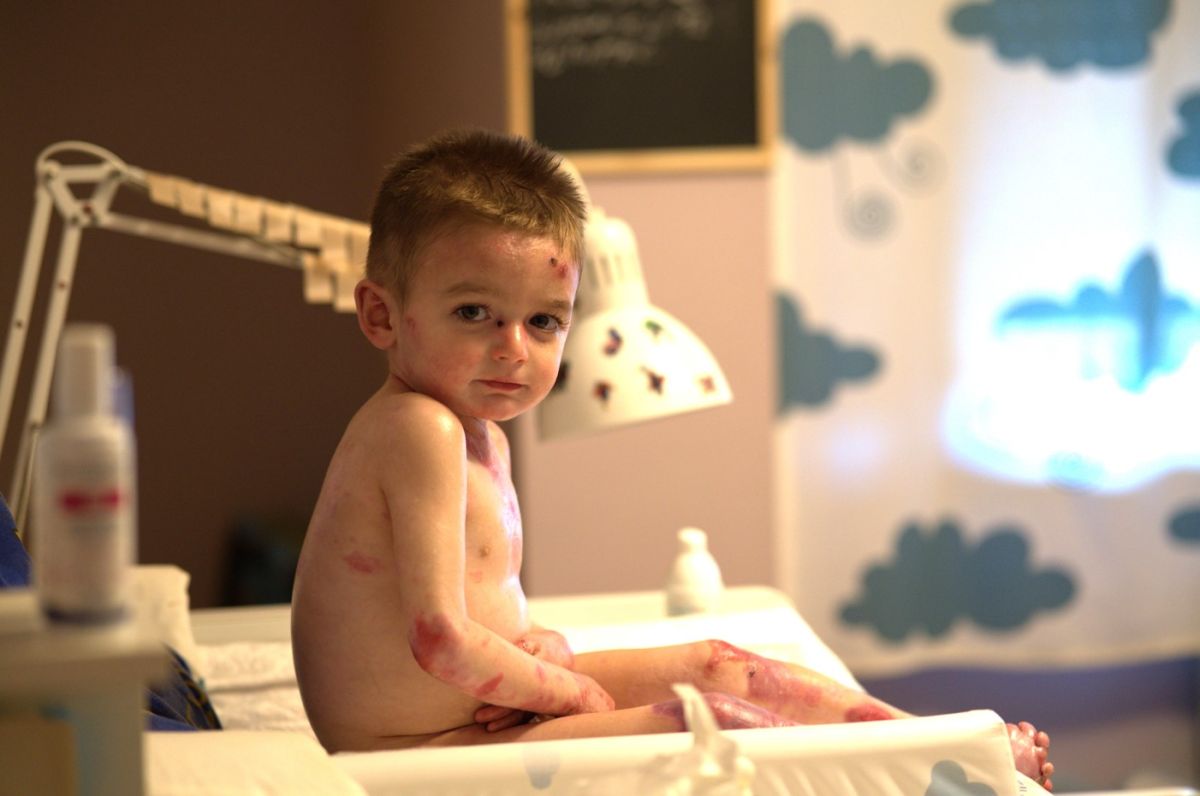
Debra Piel de Mariposa denunció este lunes que la burocracia sanitaria está "abriendo heridas" al estar atrasando la aprobación en España del medicamento 'Filusuvez', que agiliza la cicatrización de las heridas.
Este medicamento, desarrollado por la farmacéutica Amryt Pharma, ahora Chiesi, fue aprobado por la Agencia Europea del Medicamento (EMA) en junio de 2022, gracias a ello, las familias con Epidermólisis bullosa (EB) o Piel de Mariposa.
Según la directora de Debra, Evanina Morcillo, este medicamento ha permitido a los pacientes con esta enfermedad que vean "por fin un halo de esperanza".
A su vez, Morcillo recordó que la piel de mariposa es una enfermedad que supone tener "de forma continua" heridas abiertas hasta en el 90% del cuerpo, y que aún no tiene cura. Por este motivo, el acceso de este primer tratamiento indicado para la EB distrófica y juntural de aplicación tópica "es clave para mejorar su calidad de vida, ya que deben someterse diariamente a dolorosas curas diarias de hasta cinco horas".
Desde la organización, pidieron “que se cumplan los plazos establecidos y que se acelere al máximo el proceso" para que estos pacientes puedas acceder "lo antes posible" al tratamiento.
Asimismo, incidieron en que de esta manera "se evitaría el sufrimiento innecesario" de las personas con piel de mariposa que llevan esperando dos años, y que tendrán que esperar "otros tres más" hasta que se incluya en el Sistema Nacional de Salud, cuando la legislación marca un plazo máximo de 6 meses, insistieron.
España es uno de los países de la UE que más tarda en incluir los medicamentos indicados para enfermedades raras dentro de la cartera de salud. En este caso, esta demora implica que los pacientes desarrollen "complicaciones más severas, tales como carcinomas e infecciones generalizadas".
MEDICAMENTO EXTRANJERO
Debra informó que el 'Filsuavez' ya está incluido en el sistema nacional de salud de países como Alemania, por lo que algunas familias han podido solicitarlo a través de su hospital como “medicamento en situaciones especiales”.
El problema, según indicaron desde la organización, es que esta desigualdad está provocada porque en España "tenemos 17 sistemas sanitarios distintos" lo que conlleva que dependiendo de la comunidad en la que vivan las familias, "tengan más o menos facilidades para obtener este medicamento".
La organización aprovechó para anunciar la existencia de un medicamento impulsado por Krystal Biotech y desarrollado por la Universidad de Standford, 'Vyjuvez', que es uno "de los más esperanzadores" hasta la fecha y que está indicado para el tratamiento de la Epidermis bullosa distrófica.
Se trata de una terapia génica de aplicación tópica, que da la información necesaria a las células para que puedan producir, durante meses, el Colágeno 7, proteína responsable de unir la dermis y la epidermis, y de hacerla resistente a golpes y roces.
Por el momento, está aprobada por la Agencia del Medicamento de EEUU, y actualmente está en revisión por la EMA. Se espera que en octubre de 2024 haya una aprobación por parte de la Comisión Europea.
(SERVIMEDIA)
26 Feb 2024
MPB/nbc



